Negli anni sono stati riconosciuti diversi Herpesvirus nelle tartarughe, che interessano sia le specie marine, sia quelle di acqua dolce e sia le terrestri.
Gli Herpesvirus dei rettili rientrano nella famiglia degli Herpesiviridae insieme a quelli dei mammiferi e degli uccelli. Invece, i Chelonid herpesvirus 5 e 6 delle tartarughe marine, date le loro caratteristiche molecolari, sono classificati nella sottofamiglia Alphaherpesvirinae.
In particolar, il Chelonoid herpesvirus 5 è incluso insieme al Testudinid herpesvirus 3 nel genere Scutavirus.
Per quanto riguarda gli Herpesvirus delle tartarughe terresti, sono ormai identificati con facilità nelle testuggini allevate in cattività e sono classificati come “Testudinid herpesvirus” da 1 a 4 (THV1-4).
Infezione da Herpesvirus nelle tartarughe marine
Grey patch disease (GDP)
Grey Patch Disease (GPD)- associated virus (Chelonid herpesvirus 1), colpisce gli hatchings di tartaruga verde (Chelonia mydas) di cui ne causa la mortalità del 5-20%.
La malattia si presenta come delle lesioni circolari della pelle che sfociano in lesioni diffuse e grigie con una necrosi superficiale dell’epidermide e può affliggere il 90-100% delle schiuse. Le lesioni sono caratterizzate da ipercheratosi, iperplasia e acantosi. Le cellule dell’epidermide mostrano dei corpi inclusi nucleari e della cromatina marginale.
La trasmissione del virus si pensa sia verticale o attraverso l’acqua. L’improvviso cambio di temperatura dell’acqua può portare al manifestarsi dei sintomi: con una temperatura dell’acqua più bassa si ha un perdurare della malattia più lungo ma meno intenso rispetto a temperature più elevate.
Lung-eye-trachea
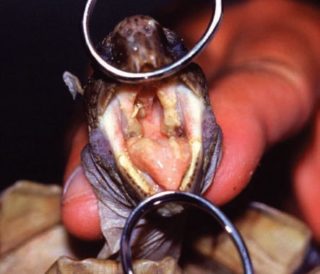
Lung-eye-trachea virus (LETV) (Chelonid herpesvirus 6), fu descritto in una tartaruga verde (Chelonia mydas) di un anno allevata in acquacoltura. Il virus interessa gli occhi e il tratto respiratorio delle tartarughe e ha un decorso clinico di 2-3 settimane. Il virus fu coltivato nelle cellule renali di tartaruga verde. L’abilità dell’LETV di crescere in vitro ha permesso la continuazione degli studi e lo sviluppo di prove sierologiche per individuare una precedente esposizione delle tartarughe al virus.
Le tartarughe affette sono spesso osservate con la bocca aperta sulla superficie dell’acqua, con duri suoni respiratori. L’infezione si diffonde velocemente tra le vasche delle tartarughe e ha un decorso clinico di 2 o 3 settimane.
Istologicamente, ci sono aree da focali a diffuse di necrosi adiacenti la glottide, che si estendono alla trachea. In alcune aree c’è degenerazione palloniforme e necrosi delle cellule epiteliali della mucosa tracheale, con corpi inclusi intranucleari anfofilici. Si può osservare una broncopolmonite e una polmonite interstiziale, con detrito necrotico e cellule infiammatorie che riempiono gli spazi aerei. In alcune aree le cellule epiteliali desquamate contengono corpi inclusi eosinofilici.
Chelonid fibropapilloma associated herpesvirus
Chelonid fibropapilloma-associated herpesvirus (CFPHV) (Chelonid herpesvirus 5), è associato allo sviluppo di fibropapillomi e fibromi nelle tartarughe marine in tutte le acque tropicali, entrambi esternamente sull’epidermide, sugli occhi, sul carapace e sul piastrone e in diversi casi sulla faccia sierosa degli organi interni.
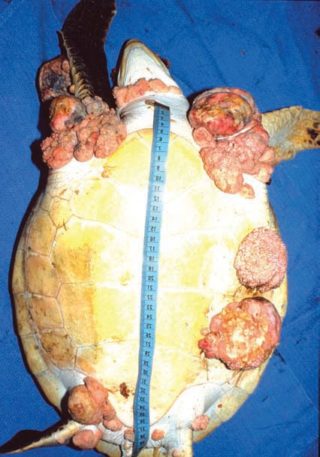
La fibropapillomatosi è la maggior malattia cronica nelle giovani tartarughe verdi (Chelonia mydas) ed era considerata la causa più importante di spiaggiamenti e mortalità nelle acque della Florida e delle Hawaii.
L’infezione da fibropapilloma herpesvirus è associata allo sviluppo di masse tumorali, diversi studi focalizzati su questa malattia hanno rivelato che si tratta di una malattia multifattoriale, quindi, è sì necessario che la tartaruga si infetti ma ciò non è sufficiente per far manifestare la malattia. La malattia si manifesta grazie all’azione di altri determinanti come sanguisughe, acari, altri virus o condizioni ambientali che in sinergia con una depressione del sistema immunitario portano al manifestarsi della malattia.
Altri due tipi di Herpesvirus sono stati identificati grazie alla PCR dalle lesioni di alcuni esemplari moribondi di Caretta caretta: uno è stato chiamato “loggerhead genital-respiratory herpesvirus” (LGRV) e l’altro “loggerhead orocutaneus herpesvirus” (LOCV). In accordo con le lesioni che vanno a provocare, sono entrambi virus opportunisti nelle tartarughe debilitate.
Infezione da Herpesvirus nelle tartarughe d’acqua dolce
Sono disponibili diversi studi riguardo le infezioni da Herpesvirus in tartarughe acquatiche. Questi sono stati descritti in Actinemys marmorata, Chrysemys picta e Graptemys ssp. I segni clinici riportati in animali infetti includono letargia, anoressia e edema sottocutaneo. Attraverso delle necroscopie si è potuto osservare anche epatomegalia e edema polmonare. Sono state riportate anche necrosi epatiche con presenza di corpi inclusi intranucleari negli epatociti. I corpi inclusi sono stati mostrati nella milza, nei polmoni, nei reni e nel pancreas.
Infezione da Herpesvirus nelle testuggini
Infezioni da herpesvirus sono state riportate in diverse specie di testuggini (Testudinidae).
I segni clinici comunemente associati con le infezioni includono riniti, congiuntiviti, stomatiti e glossiti, che frequentemente sviluppano in stomatiti necrotizzanti e glossiti, con membrane difteroidi che coprono parti della cavità orale e si estendono giù per la trachea e l’esofago. L’edema sul collo è un segno comune. Gli animali affetti sono in genere anoressici e letargici. Animali che sopravvivono a infezioni acute da Herpesvirus possono sviluppare disordini del sistema nervoso centrale che includono paralisi o scoordinazione. In uno studio di trasmissione, a delle Testudo graeca è stato inoculato un HV delle testuggini sia per via intramuscolare che intranasale, hanno sviluppato sintomi della malattia coerenti con l’infezione da HV.
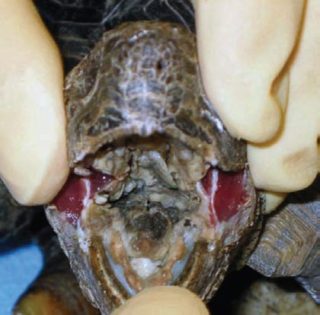
Istologicamente, le infezioni da HV nelle testuggini possono essere associate a inclusioni intranucleari eosinofile o anfifiliche nei tessuti infetti, più frequentemente nelle cellule epiteliali della lingua, della mucosa orale, e del tratto respiratorio così come del tratto intestinale. Occasionalmente, le inclusioni possono essere trovate anche nelle cellule epiteliali del tratto urinario, nel cervello, nella milza e nel fegato.
L’ICTV ha messo in lista diversi Herpesvirus dei cheloni senza una classificazione nella famiglia Herpesviridae. Tuttavia, molti dei virus in lista sono stati descritti solamente al microscopio elettronico, e non è lontana una classificazione di questi virus.
Il primo Herpesvirus delle testuggini di cui è stata disponibile una sequenza del gene della DNA polimerasi, permettendo un’analisi tassonomica preliminare dell’isolato, derivava da una Testudo horsfieldii e da una Malacochersus tornieri in Giappone. Studi sugli Herpesvirus dalle testuggini europee hanno mostrato che virus simili possono essere trovati anche in T. horsfieldii in Europa, ma questi virus differiscono dalla maggior parte di quelli trovati nelle testuggini mediterranee tenute come animali domestici in Europa, creando due genogruppi distinti.
Un altro Herpesvirus distinto è stato trovato in una tartaruga del deserto della California (Gopherus agassizii) negli USA.
Un quarto HV è stato trovato in una Chersina angulata in uno zoo sempre negli USA.
Dopo vari cambiamenti nella nomenclatura, questi virus sono stati nominati come “Testudinid HVs” (Herpesvirus delle testuggini) con abbreviazione TeHV.
Le specie individuali del virus sono poi state numerate in base alla data di pubblicazione, così il virus trovato nella T. horsfieldii e nella M. tornieri in Giappone e in Europa è stato nominato TeHV1, il virus trovato nella G. agassizii come TeHV2, il virus maggiormente riscontrato nelle testuggini mediterranee come TeHV3 e il virus trovato nella C. angulata come TeHV4. Alcuni di questi virus hanno mostrato di essere capaci di infettare diverse specie nella famiglia Testudinidae.
Il TeHV1 è stato maggiormente descritto nelle T. horsfieldii, ma può anche infettare diverse altre specie. È generalmente associato ad un basso tasso di morbilità e mortalità.
Il TeHV3 è stato trovato in molte diverse specie di testuggini, più comunemente in T. graeca, T. marginata, T. hermanni e T. horsfieldii. È interessante che queste specie mostrano una diversa suscettibilità alla malattia da HV. Le infezioni da TeHV3 in T. hermanni e T. horsfieldii sono in genere associate ad alta morbilità e mortalità, mentre le T. graeca sembrano essere più resistenti alla malattia. Questo potrebbe essere un riflesso della storia evolutiva del virus, e si pensa che questo possa essere un virus delle T. graeca e che le infezioni ad altre specie ospiti rappresentino un salto evolutivo con conseguenti maggiori tassi di mortalità. Anticorpi contro il TeHV3 sono stati trovati in T. graeca di cattura in Turchia. Tuttavia, per dimostrare questa ipotesi c’è bisogno di altri studi.
Negli anni a seguire, altri Herpesvirus sono stati rilevati o isolati in diverse specie come Geochelone chilensis, Testudo graeca, Testudo horsfieldii, Geochelone denticulata, Geochelone pardalis, Malacochersus tornieri, Testudo marginata e Testudo kleinmanni.
TeHV-1 e TeHV-3 (Eurasia): il TeHV-1 e il TeHV-3 sono stati i primi due TeHVs a essere isolati e sono i migliori che sono stati sequenziati fino ad oggi. Sono entrambi presenti in Europa sebbene siano stati trovati anche in altri continenti. Mentre il TeHv-3 è più riscontrabile nelle tartarughe di allevamento e generalmente associato ad un’alta mortalità e morbilità, il TeHv-1 è normalmente ritrovato in contesti di epidemie caratterizzati da bassa morbilità e mortalità. Come riportato precedentemente, si è visto che entrambi i virus sono presenti nelle Testudo graeca selvatiche in Turchia, ciò suggerisce che questo sia entrato nel commercio di tartarughe da allevamento a causa della cattura per il commercio di animali selvatici. La sieroprevalenza dei due nelle Testudo graeca di cattura era diversa (rispettivamente 5,5% e 37%) e la distribuzione dei sieropositivi non era omogenea sull’intero territorio turco, con le testuggini positive al TeHV-3 più ampiamente distribuite rispetto a quelle positive al TeHV-1. Testuggini positive ad entrambi sono state trovate in individui originari della Turchia centrale e del sud. Mentre non sono stati trovati positivi nella regione ad est del paese. Le testuggini prese in esame erano di origine selvatica ma cresciute in cattività e alcune di loro potrebbero essere state infettate in cattività. Tuttavia, è possibile che questi risultati possano in parte riflettere l’attuale prevalenza dell’infezione e della distribuzione del virus nelle Testudo graeca selvatiche della Turchia.
Non è chiaro se il TeHV-1 e il TeHV-3 si sono coevoluti con una o più specie di tartarughe infette. Per provarlo si necessitano di più dati. Visti i risultati dello studio di Marschang e Schneider (2007) sulle Testudo graeca, sembra che il TeHV-3 sia il sierotipo predominante in questa specie in natura. Dall’altro canto invece, il TeHV-1 sembra essere molto presente nelle Testudo horsfieldii. È interessante sapere che filogeneticamente queste due specie derivano da gruppi diversi. Questo potrebbe suggerire che un’ipotetica associazione tra il virus e l’ospite in queste due specie sia influenzata dalla genetica, ma servono altri studi per confermarlo. La similitudine secondo cui le Testudo hermanni potrebbero essere l’ospite originale del TeHV-1 o del TeHV-3 (o entrambi) è probabilmente più bassa considerando l’alto numero di morti che si hanno quando gli esemplari selvatici di questa specie vengono infettati dal virus; quindi, è più probabile che sia un ospite accidentale. Soares e colleghi (2004) hanno scritto che il TeHV-3 è stato trovato più spesso nelle Testudo marginata e nelle Testudo graeca ibera rispetto che nelle altre specie.
TeHV-2 (America): è un Herpesvirus ritrovato sia negli esemplari selvatici che domestici di Gopherus agassizii nella loro area di distribuzione naturale. La presenza dell’Herpesvirus nelle Gopherus agassizii è conosciuta dal 1982; comunque nessun tentativo di sequenziamento era stato fatto prima del 2005 e non è comunque possibile confermare se tutti i casi di infezione da Herpesvirus nelle Gopherus agassizii possano essere collegati al TeHV-2. L’origine di questo virus rimane sconosciuta così come se sia co-evoluto con le Gopherus agassizii. Uno spillover di questo virus su altre specie di testuggini non può essere escluso e richiede più studi. Ad oggi il genotipo di questo virus è stato riscontrato solamente negli Stati Uniti.
Il TeHV-2, nonostante la sua genetica diversa dal TeHV-3, è probabile che condivida alcuni antigeni con questo altro genotipo perché gli anticorpi anti-TeHV-2 hanno una reazione incrociata con i virioni TeHV-3 (nel test ELISA). La più alta sieroprevalenza per il TeHV-2 nelle Gopherus agassizii è stata trovata nella parte est del deserto del Mojave.
TeHV-4 (Africa): il TeHV-4 è il TeHV che è stato scoperto più recentemente. È stato trovato in una Chersina angulata asintomatica e di cattura. La testuggine era originaria di un sito sudafricano e non è chiaro se l’infezione sia avvenuta in natura o durante il suo periodo in cattività. Di conseguenza, se la testuggine si fosse infettata in natura, l’areale di origine del virus combacerebbe con l’areale di distribuzione di questa specie e quindi il Sud Africa e la Namibia. Non ci sono stati altri ritrovamenti di questo virus.
TeHVn: non ci sono informazioni sierologiche o molecolari concernenti gli Herpesvirus trovati nelle Geochelone pardalis, Malacochersus tornieri e Chelonoidis chilensis; di conseguenza, è impossibile correlarli ad altri TeHVs conosciuti. Anche in una Testudo horsfieldii è stato trovato un virus Herpesvirus non sequenziato associato a una epatite necrotica. È molto probabile che esistano altri TeHV e alcuni potrebbero dimostrarsi altamente patogeni in alcune specie di testuggini, mentre altri potrebbero essere trovati accidentalmente non manifestando potere patogeno. La scoperta di nuovi TeHV ci permetterebbe di capire meglio il significato biologico di questi virus nelle popolazioni di tartarughe nel mondo.
Proprietà fisiche del virus
Il TeHV-3 è quello che è stato meglio caratterizzato, è un classico Herpesvirus con un nucleocapside caratterizzato da una struttura icosaedrica circondata da un tegumento e un envelope lipidico. Il virus è stato visto essere sensibile al cloroformio, come ci si aspetta da un virus ad envelope, e al 5-iodo-2-desossiuridina come ci si aspetta dai virus a DNA. Sono stati condotti studi sperimentali per valutare gli effetti dell’ambiente sull’infettività virale in diverse condizioni. Il virus rimane infettivo per diverse settimane a 4°C in acqua di lago o potabile ma ha una significativa riduzione dell’infettività a temperatura ambiente (1-8 settimane) e a 37°C (da 3 giorni a 6 settimane). Questi dati suggeriscono che il suolo e l’acqua contaminati possono servire come una fonte di infezione per le tartarughe selvatiche e quindi affinché avvenga l’infezione non è strettamente necessario che ci sia il contatto tra un esemplare infetto e un esemplare sano.
Segni clinici
La maggior parte delle informazioni che sono riportate in letteratura concernenti le malattie associate ai TeHV si riferiscono al TeHV-3. Sono disponibili poche informazioni concernenti le condizioni di malattia associate alle infezioni da TeHV-1 e da TeHV-2, e non ci sono report di casi clinici associati al TeHV-4.
La malattia sviluppa come una patologia delle alte vie respiratorie e del tratto digerente, con scolo oro-nasale, dispnea, congiuntivite mono o bilaterale seguita da placche difteronecrotiche della mucosa orale, della lingua e occasionalmente anche dell’esofago e dell’intestino.
Sono stati osservati anche malattia del sistema nervoso centrale e segni neurologici più generali come letargia, perdita di peso e cachessia.
Si pone in diagnosi differenziale con mycoplasmosi e iridovirosi.
Diagnosi
Isolamento virale, PCR, sierologia.
Fonti:
- Viruses in reptiles (Ellen Ariel) (2011)
www.veterinaryresearch.org/content/42/1/100 - Comparison of 11 herpesvirus isolates from tortoises using partial sequences from three conserved genes (2006)
(Marschang, Gleiser, Papp, Pfitzer, Bohm, Roth) - Viruses infecting reptiles (Rachel E. Marschang) 2011
doi:10.3390/v3112087 - Testudinid Herpesviruses: a review (Francesco C. Origgi 2012)
Fonte foto:
“Infectious diseases and patology of reptiles” di Elliott R. Jacobson
- (in evidenza) Chelonia mydas. Cheloniidae.
LET (lung, eye, and tracheal) disease.
Materiale caseoso adiacente all’apertura della glottide - Chelonia mydas con fibropapilloma
- Gopherus agassizii. Testudinidae.
Cavità orale diffusamente necrotica - Geochelone chilensis.
Detriti necrotici sulla lingua e sulla mucosa palatina






